Momenteel doe ik literatuuronderzoek naar androgene regulatie van anabole en katabole reactiepaden. Onderstaand een korte blik op enkele bevindingen die ik heb gedaan.
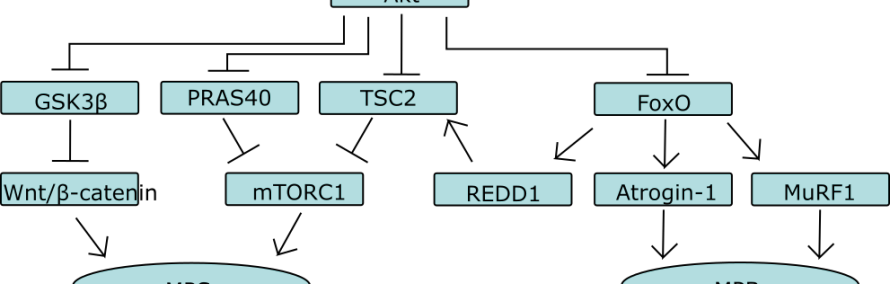
Een centrale speler in de anabole en katabole reactiepaden is de eiwitkinase familie Akt (ook wel proteïne kinase B [PKB] genoemd). In essentie reguleert Akt drie dingen:
- Wnt/β-catenine signalering
- mTORC1 (mammalian/mechanistic target of rapamycin complex 1)
- FoxO familie
Wnt/β-catenine signalering is betrokken bij myogenese, maar ook bij hypertrofie van spiercellen ansich. In dit artikel besteed ik er geen aandacht aan.
De tweede van het rijtje, mTORC1, is een eiwitkinase complex die centraal staat in de regulatie van de eiwitsynthese. Het complex integreert verschillende cellulaire signalen, zoals de energiestatus, aminozuurbeschikbaarheid en groeifactoren. Activatie van het complex leidt tot fosforylering van twee sets van substraten, te weten: i) de eukaryotic initiation factor 4E (eIF4E)-binding proteins 4E-BP1 en 4E-BP2, en ii) de ribosomal S6 kinases S6K1 en S6K2. De 4E-BPs remmen de formatie van het translatie initatie complex eIF4F. eIF4F recruiteert de small (40S) ribosomal subunit naar het 5′-einde van het DNA voor translatie initiatie. Door hindering van de vorming van het complex eIF4F, wordt dus 5′-cap-einde-afhankelijke translatie geremd. mTORC1 is in staat om deze remming op te heffen door 4E-BPs te fosforyleren. S6Ks moduleren eveneens translatie initiatie en bevorderen ook ribosomale biogenese. Fosforylering van S6Ks door mTORC1 activeert de kinases.
De FoxO familie staat centraal in de regulatie van eiwit-afbraak door modulatie van zowel ubiquitine-proteasomale, als ook autofagie-lysosomale proteolytische reactiepaden. Met name het ubiquitine-proteasomale systeem staat centraal in de eiwit-afbraak van spiercellen. De twee belangrijkste downstream effectoren van de FoxO familie zijn de twee E3 ubiquitine ligases muscle atrophy F-box (MAFbx/atrogin-1) en muscle ring finger 1 (MuRF1).
Deze drie worden, zoals eerder gezegd, o.a. gereguleerd door Akt. Wnt-β-catenine signalering wordt gestimuleerd doordat Akt een negatieve regulator (GSK3β) van het reactiepad (die leidt tot afbraak van β-catenine) fosforyleert en daardoor remt.
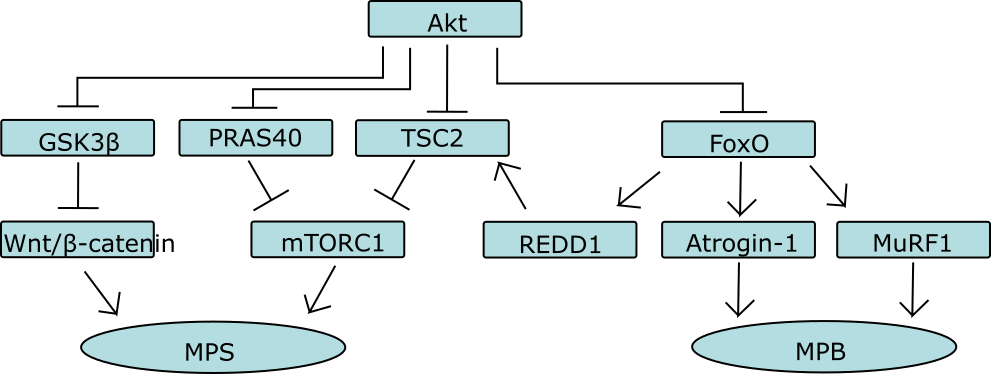
mTORC1 activatie wordt op twee manieren gestimuleerd door Akt. Één van de manieren is door het complex te bevrijden van een eiwit (PRAS40) door deze te fosforyleren waardoor deze dissocieert van het complex. De andere manier is door remming van het TSC1/2 complex. Het TSC1/2 complex is een belangrijke negatieve regulator van mTORC1. TSC staat voor tuberous sclerosis, een ziekte die de groei van goedaardige tumoren in verscheidene organen veroorzaakt. Dit komt doordat er een mutatie is die ervoor zorgt dat het TSC1/2 complex niet meer mTORC1 kan remmen; hierdoor kan mTORC1 ‘ongestoord’ zijn gang gaan en gaat de eiwitsynthese als het ware in overdrive (als ook andere cellulaire processen die te maken hebben met proliferatie en groei). Oftewel: een ideale situatie voor de groei van tumoren. Het TSC1/2 complex bestaat uit drie moleculen: TSC1, TSC2 en het recentelijk geidentificeerde eiwit TBC1D7. TSC1/2 remt mTOR doordat het bepaalde moleculen inactief maakt die mTORC1 direct activeren. Deze moleculen, Rheb genoemd, activeren mTORC1 door een nog onbekend mechanisme wanneer zij gebonden zijn aan nucleotide GTP. Wanneer zij gebonden zijn aan GDP zijn zij inactief. TSC1/2 beschikt over een GTPase activating protein (GAP) domein, wat simpelweg betekent dat het complex in staat is om Rheb-GTP te hydrolyseren tot Rheb-GDP. Oftewel: het inactiveert de GTP-gebonden Rheb eiwitten die mTORC1 activeren. Hoe Akt dit voorkomt is nog niet helemaal zeker. Men is er lange tijd van uitgegaan dat Akt TSC2 fosforyleert op verschillende plaatsen waardoor het niet meer een complex kon vormen. Daarnaast zou het ook de GAP activiteit remmen of teniet doen. Recenter onderzoek wijst er echter op dat fosforylering van TSC2 ervoor zorgt dat het molecuul weggaat bij het lysosoom: de plek waar Rheb-GTP zich bevindt. In ieder geval: Akt remt TSC2, en stimuleert daardoor mTORC1 activiteit.
Tot slot remt het de FoxO familie van eiwitten door fosforylering, waardoor de downstream effectoren van FoxO niet geactiveerd worden.
Om het plaatje nog iets completer te maken: de Akt familie bestaat uit drie isoformen. D.w.z. drie verschillende soorten moleculen die dezelfde functie vervullen (i.e. dezelfde reactie catalyseren), maar verschillen in hun aminozuursequentie (i.e. de aminozuren waaruit ze zijn opgebouwd). Deze drie isoformen heten simpelweg Akt1, Akt2 en Akt3. Akt1 en Akt2 komen tot expressie in skeletspierweefsel, Akt3 niet. Akt wordt geactiveerd doordat het gefosforyleerd wordt op twee residuën. In het geval van Akt1 zijn dit Ser473 en Thr308 en in het geval van Akt2 Ser474 en Thr309. Fosforylering van beide residuën is benodigd voor volledige activiteit van de kinase. Het threonine residue wordt gefosforyleerd door PDK1 en het serine residue door mTORC2 (een complex die eveneens de mTOR kinase bevat). In de meeste studies in spiercellen wordt gekeken naar de status van Akt1.
Gemengde resultaten op Akt-fosforylering door androgenen
Studies lijken elkaar nog weleens tegen te spreken doordat {x} leidt tot {y} in studie 1, maar bijv. niet leidt tot {y} in studie 2 onder -ogenschijnlijk- identieke omstandigheden. Toch hoeft er zeker geen sprake te zijn van tegenstrijdige resultaten. Heel veel studies verschillen nu eenmaal in hun opzet. Denk hierbij bijv. aan het gebruik van een andere cellijn of andere dosering. Nog vervelender wordt het als zelfs het passage nummer (hoe vaak een cellijn is gedeeld) tot resultaten leidt die 180 graden op elkaar staan. Zo laat een studie in een prostaatkankercellijn (LNCaP) zien dat, gegeven dat alle omstandigheden identiek zijn m.u.v. het passage nummer, androgenen tegengestelde effecten kunnen hebben op Akt-gefosforyleerde AR transcriptionele activiteit [1].
Een andere studie laat eveneens bijzondere resultaten zien [2]. Onderzoekers denerveerde de gastrocnemius van ratten, direct daarna kregen ze nandrolon toegediend. Een expressie array van genen werd vervolgens in kaart gebracht 7 dagen na deze interventie. Een andere groep ratten, eveneens met een gedenerveerde gastrocnemius kregen nandrolon niet direct toegediend, maar pas 28 dagen later. Ook hier werd na 7 dagen (dus op dag 35) een expressie array van genen in kaart gebracht. Er werden gigantische verschillen gevonden tussen de expressie arrays van beide groepen. Dit benadrukt wederom hoe belangrijke de cellulaire context is voor het effect van androgenen.
Wat betreft de androgene regulatie van Akt-fosforylering laten sommige studies wel een effect zien [3,4,5,6], maar andere niet [7,8,9].
What gives? Helaas is er een extreme heterogeniteit te bemerken van de studies. Zo worden nandrolon, testosteron en dihydrotestosteron allen gebruikt. Testosteron aromatiseert naar het oestrogeen oestradiol en nandrolon aromatiseert veel minder. Dihydrotestosteron aromatiseert zelfs helemaal niet en wordt (hoewel niet helemaal correct) dan ook als een ‘puur’ androgeen gezien. Bovendien is van nandrolon bekend dat het, na binding met de androgeen receptor, ook bindt aan oestrogene response elementen. Evenzo is het niet onvoorstelbaar dat er diversiteit is tussen de androgene response elementen waaraan verschillende androgeen-receptorcomplexen binden.
Verder zijn er natuurlijk de ‘gebruikelijke’ verschillen qua modellen. Zo worden er gecastreerde muizen gebruikt in de ene studie, gecastreerde ratten in de andere, burn-injured ratten in weer een andere, of natuurlijk cellijnen in wéér andere. De doseringen liggen -gelukkig- bij de in vivo modellen in ongeveer dezelfde lijn. Daartegenover staat wel weer dat de meetpunten aanzienlijk kunnen verschillen: varierend van 1 dag tot 3 maanden. En hoewel de meeste studies de fosforylering status van Akt bepaalden op Ser473, waren er twee die dit deden op Thr308.
Rode draad: stimulering van Akt-fosforylering
Toch is er een rode draad te bekennen. De drie studies [7,8,9] die geen effect op Akt-fosforylering lieten zien wijken sterk af van de overige studies. De eerste [7] was een studie uitgevoerd op gecastreerde ratten die nandrolon (3 mg/kg bw/d) of dihydrotestosteron (single-3m-release pellet van 150 mg) kregen voor 3 maanden. Drie maanden is een lange, lange tijd. Het kan prima zijn dat er zonder verdere anabole signalen, zoals bijv. een trainingsprikkel, de verhoogde fosforylering status ophoudt. Het blijft niet altijd feest. De tweede [8] betrof een studie waarbij ratten werden ondergedompeld in kokend water om als brandwondenmodel te fungeren. De ratten kregen een single-15d-release pellet van 20 mg testosteron, en er werden metingen verricht op dag 1, 4, 7 en 14. Tot mijn spijt rammelt de publicatie echter aan alle kanten. Zo schrijven ze dat testosteron de daling in serum IGF-I remt, maar hun figuur ondersteunt dit niet. Ook schrijven ze dat testosteron niet de daling van een spiereiwit (3-methylhistidine) in de urine remde @ dag 14, terwijl hun figuur zegt van wel. Verder schrijven ze dat er geen verschil was in de IGF-I levels tussen de groepen en refereren hiermee naar een figuur die iets heel anders weergeeft. Ook de overige figuren in de publicatie geven geen IGF-I niveaus weer… Ook maten ze fosforylering van Akt op Thr308 (meeste meten @ Ser473, de fosforyleringsplek van mTORC2), en vermelden ze foutief in hun Western Blot afbeelding dat ze fosforylering van FoxO3A maten @ Thr308 (dat kan uberhaupt niet). Al met al is het verbazingwekkend dat dit langs peer-review is gekomen… De laatste studie [9] die geen effect vermeldt op Akt-fosforylatie bekeek het effect hiervan in L6 myoblasten (die dus nog moeten differentieren tot ‘volwassen’ spiercellen) die de AR tot expressie brengen. Ze werden geincubeerd met testosteron (100 nM) en metingen werden verricht @ 20 minuten, 2 uur en 20 uur. Ook zij maten de fosforylatie status van Akt @ Thr308…
- Lin, Hui-Kuan, et al. “Suppression versus induction of androgen receptor functions by the phosphatidylinositol 3-kinase/Akt pathway in prostate cancer LNCaP cells with different passage numbers.” Journal of Biological Chemistry 278.51 (2003): 50902-50907.
- Qin, Weiping, et al. “Differential alterations in gene expression profiles contribute to time-dependent effects of nandrolone to prevent denervation atrophy.” BMC genomics 11.1 (2010): 596.
- White, James P., et al. “Testosterone regulation of Akt/mTORC1/FoxO3a signaling in skeletal muscle.” Molecular and cellular endocrinology 365.2 (2013): 174-186.
- White, James P., et al. “Effect of nandrolone decanoate administration on recovery from bupivacaine-induced muscle injury.” Journal of Applied Physiology 107.5 (2009): 1420-1430.
- Basualto-Alarcón, Carla, et al. “Testosterone signals through mTOR and androgen receptor to induce muscle hypertrophy.” Medicine and science in sports and exercise 45.9 (2013): 1712-1720.
- Jones, Amanda, et al. “Effects of a novel selective androgen receptor modulator on dexamethasone-induced and hypogonadism-induced muscle atrophy.” Endocrinology 151.8 (2010): 3706-3719.
- Hourde, C., et al. “Androgen replacement therapy improves function in male rat muscles independently of hypertrophy and activation of the Akt/mTOR pathway.” Acta physiologica 195.4 (2009): 471-482.
- Ma, Li, et al. “Extracellular Signal–Regulated Kinase–Mammalian Target of Rapamycin Signaling and Forkhead-Box Transcription Factor 3a Phosphorylation Are Involved in Testosterone’s Effect on Severe Burn Injury in a Rat Model.” Shock 43.1 (2015): 85-91.
- Wu, Yong, et al. “Testosterone-induced hypertrophy of L6 myoblasts is dependent upon Erk and mTOR.” Biochemical and biophysical research communications 400.4 (2010): 679-683.