Fosfatidezuur (PA, van het Engelse phosphatidic acid) suppletie stimuleert spierhypertrofie wanneer deze wordt gecombineerd met krachttraining blijkt uit een recente studie van Joy et al. [1]. De werking lijkt via activatie van het mTOR complex, een belangrijke signaal integrator van energie status, aminozuren beschikbaarheid, groeifactoren en mechanische stress. PA wordt dan ook al jaren gezien als een belangrijke upstream regulator van de mTOR pathway en, i.t.t. de eiwitkinases die hierbij betrokken zijn, kan PA als zijnde een lipide wel gesuppleerd worden en direct de PA concentratie ([PA]) in de spiercellen verhogen. PA sluit dan ook mooi aan bij het repertoir aan lipiden met een mogelijk anabool effect, zoals arachidonzuur.
Wat is fosfatidezuur (PA)?
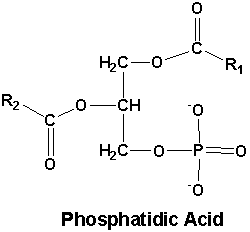
Fosfatidezuur (PA) is een vorm van diacylglycerolfosfolipiden. Een hele mond vol, maar waar het op neerkomt is dat het bestaat uit glycerol-3-fosfaat, met de eerste twee C-atomen veresterd met een vetzuur (en het derde dus met een fosfaatgroep, en in het geval van fosfatidezuur als een zuur). PA komt in kleine hoeveelheden voor in cel- en organelmembranen, en doorgaans is het eerste C-atoom veresterd met een verzadigd C16 of C18 vetzuur, en het tweede C-atoom met een C16, C18 of C20 onverzadigd vetzuur.
PA kan in de cellen gesynthetiseerd worden vanuit verscheidene substraten door verschillende enzymen. Evenzo kan PA gemetaboliseerd worden door verscheidene enzymen. De synthese en metabolisatie bepalen beide dus de concentratie van PA ([PA]). De synthese kan plaatsvinden door het enzym fosfolipase D (PLD) die het substraat fosfatidylcholine hydroliseert. Verder kan PA ook gesynthetiseerd worden uit diacylglycerol en lysofosfatidezuur, gecatalyseerd door diacylglycerol kinase en lysofosfatidezuur acyltransferase, respectievelijk. Metabolisatie van PA staat onder regulatie van fosfolipase A (PLA) en fosfatidezuur fosfatases (PAP). Thans is het meest onderzoek verricht naar de regulatie van [PA] door PLD.
Het anabole effect van PA vloeit voort uit diens belangrijke rol als upstream activator van de mTOR pathway [2]. Deze pathway licht ik uitgebreid toe bij het volgende kopje, voor de mensen die hier al enigszins mee bekend zijn: rapamycin, een specifieke mTOR antagonist, blokkeert de mechanische geïnduceerde stijging in de eiwitsynthese van skeletspiercellen. Dit doet het door een complex te vormen met FKPB12, waarna het direct bindt aan mTOR op het FRB domein. PA bindt ook aan dit domein [3]. Mechanisch gestimuleerde spiercellen hebben een verhoogde IC50 voor rapamycin voor het remmen van S6K1 fosforylatie (downstream effector van mTORC1) [4]. Dit suggereert dat er competitie plaatsvindt tussen rapamycin en PA voor binding aan het FRB domein. Mogelijk speelt PA dus een belangrijke rol bij mTORC1 activatie door mechanische stimulatie (i.e. krachttraining).
mTOR regulatie
Dit is een vrij lang stuk geworden: scroll door naar het volgende kopje om over de klinische studie te lezen.
Graag licht ik de mTOR pathway, waar ik maar al te vaak over spreek, eens uit. mTOR is namelijk extreem belangrijk voor de groei van je spieren na een krachttraining sessie. Kort door de bocht zou je kunnen stellen dat het blokkeren van mTOR ervoor zou zorgen dat je totaal geen spiermassa meer gaat aanzetten. Het integreert precies de signalen waarvan we allemaal weten dat ze rete belangrijk zijn voor spiergroei:
- Aminozuren beschikbaarheid (voldoende eiwit)
- Energiestatus (voldoende kcal)
- Groeifactoren (insuline/IGF-I)
- Mechanische stress (krachttraining)
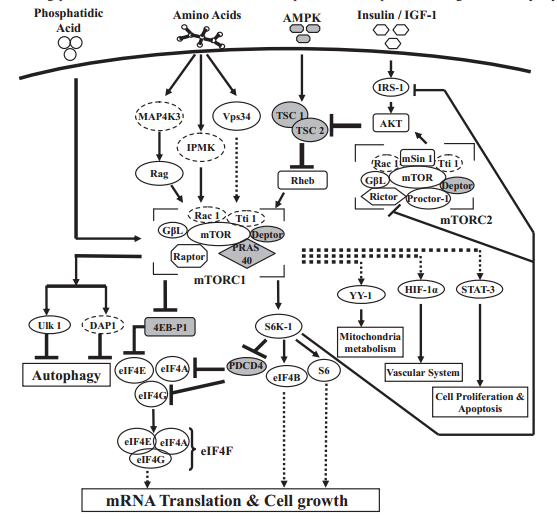
Al deze signalen komen bijeen op 1 punt, en dat punt is mTORC1 (no worries, ik licht zo toe wat die C1 nu inhoudt). mTORC1 beinvloedt vervolgens de laatste stap in de vorming van eiwitten: de translatie van mRNA naar eiwit door de ribosomen. En dan met name de initiatie van de translatie.
Nu wordt het tijd om mTOR te ontmoeten. mTOR is een kinase eiwit en vormt samen met de eiwitten GβL en Raptor een complex genaamd mTORC1. Wanneer mTOR uithangt met GβL en Rictor vormt het het complex genaamd mTORC2. mTORC1 is het complex waar we in geïnteresseerd zijn wanneer het om de eiwitsynthese gaat (al lijkt nieuw materiaal erop te wijzen dat mTORC2 ook enige invloed heeft, maar die ga ik verder niet behandelen).
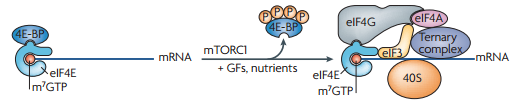
mTORC1 fosforyleert enkele substraten na activatie. De twee belangrijkste substraten die mTORC1 fosforyleert zijn 4E-BP1 en S6K1. Die eerste is een bindingseiwit. Meer specifiek: het bindt aan eIF4E, een translatiefactor. Zoals gezegd beinvloedt mTORC1 met name de translatie initiatie, ofwel de binding van het ribosoom aan het mRNA. Ribosomen binden vaak (maar niet altijd) aan een uiteinde van de mRNA streng (het 5′ einde), en lopen dan over de streng tot ze een start codon tegenkomen. Nu wil het dat eIF4E bindt aan het 5′ einde, en wanneer 4E-BP1 gebonden is aan eIF4E, translatie simpelweg niet kan beginnen. Ofwel: 4E-BP1 remt translatie. Wanneer mTORC1 4E-BP1 fosforyleert dissocieert het van eIF4E, en kan eIF4E twee additionele translatie factoren recruiteren, namelijk: eIF4G en eIF4A. Samen vormen deze drie het eIF4F complex. Vervolgens kan het ribosoom binden en het mRNA uitlezen en kan translatie zijn gang gaan. Er zitten iets meer haken en ogen aan, maar you get the picture. Het tweede belangrijke substraat die mTORC1 fosforyleert (en daarmee activeert) is S6K1. S6K1 is zelf ook een kinase en fosforyleert zelf enkele translatie factoren en RNA bindingseiwitten wat uiteindelijk leidt tot meer translatie (ofwel meer eiwitsynthese).
En hoe wordt mTORC1 dan zelf geregeld? Zoals eerder gezegd integreert het dus precies die signalen waarvan we weten dat ze spiergroei bevorderen. Het best onderzochte is de signaleringscascade na activatie van de insuline receptor of IGF-I receptor: de PI3K/Akt/mTOR pathway (Akt wordt ook wel eiwit kinase B [PKB] genoemd). Hierbij worden de insuline receptor substraten (IRS1 en IRS2) gefosforyleerd die op hun beurt zorgen voor activatie van PI3K (een kinase) [5]. PI3K fosforyleert inositol fosfolipiden op de C3 hydroxylgroep en geeft zo 3′-fosfoinositides, waaronder PIP3. PIP3 bindt aan het pleckstrin-homologie domein op Akt en recruiteert zo Akt naar het celmembraan en daarnaast vindt er een conformationele wijziging plaats waardoor Akt gefosforyleerd (en zodoende geactiveerd) kan worden. Akt wordt gefosforyleerd op twee posities, en fosforylatie van beide residuen is benodigd voor volledige activiteit [6]. Het ene residue wordt gefosforyleerd door PDK1 [7], en de ander mogelijk door mTORC2 [8].
Akt kent vervolgens een tweevoudige werking om mTORC1 te activeren. De eerste is TSC1/2 afhankelijk. TSC1/2 is een eiwit complex bestaande uit TSC1 en TSC2 en remt mTOR door toedoen van zijn GTPase activiteit. Akt fosforyleert TSC2 en remt hiermee zijn functie, als ook de mogelijkheid om het TSC1/2 complex te vormen [9]. De tweede manier waarop Akt mTORC1 activatie stimuleert is via het PRAS40 eiwit wat bindt aan mTOR en zo het complex remt. Dit doet Akt door PRAS40 te fosforyleren waarna het dissocieert van mTOR [10].
De integratie van de cellulaire energie status verloopt met name via de AMP geactiveerde eiwit kinase (AMPK). AMPK meet de cellulaire energie status met name aan de hand van de AMP:ATP en ADP:ATP ratio [11]. Wanneer energie wordt gebruikt daalt tenslotte de hoeveelheid ATP, en stijgen de hoeveelheden AMP en ADP. AMPK fosforyleert ook TSC2, net als Akt, echter op enkele andere residuen waardoor het nu net wordt geactiveerd en zo mTORC1 remt [12]. Tevens fosforyleert AMPK Raptor en remt zo mTORC1 [12]. Een gunstige energie status bevordert dus mTORC1 activatie door remming van AMPK (en bijgevolg dus van het TSC1/2 complex).
Activatie van mTORC1 door aminozuren toevoer werkt op vele manieren. Gehypothetiseerd is dat dit ook werkt via een PI3K (meer specifiek Vps34, een klasse 3 PI3K) die geactiveerd wordt door binding met calmodulin in reactie op een stijging van intracellulair [Ca2+] [13]. Daarnaast induceren aminozuren binding van mTORC1 met RAG eiwitten die zorgen voor lokalisatie van mTORC1 op het lysosomale membraan, waar het geactiveerd kan worden door de GTP gebonden Rheb eiwitten [14]. Verdere mechanismen worden behandeld in [15].
En het beste voor laatst: activatie van mTORC1 door mechanische stress. Mechanische stress zorgt voor een stijging in [PA] [16]. Dit lijkt momenteel het primaire mechanisme te zijn hoe krachttraining dus mTORC1 activeert. Hoe precies is nog onduidelijk, maar de focus ligt op de enzymen die PA synthetiseren en afbreken, en in het specifiek PLD (al verklaart PLD activiteit op zichzelf staand niet de stijging in [PA] door krachttraining). Hierop speelt PA suppletie dan ook in, door [PA] te verhogen, en zodoende te leiden tot meer mTORC1 activatie.
Fosfatidezuur suppletie: de resultaten
Welnu, de studie van Joy et al [1]. Het onderzoek bestaat uit twee delen: een in vitro onderzoek en een klinisch onderzoek. Het in vitro onderzoek vertelt ons voornamelijk welke variant van PA waarschijnlijk het effectiefst is. Soja afgeleide PA werd uitgezet tegen ei afgeleide PA. Hoewel beide effectief waren om mTORC1 te stimuleren (gemeten aan de hand van de fosforylatie staat van S6K1 op t389), was de soja afgeleide PA duidelijk superieur. Dit komt waarschijnlijk door de verhouding verzadigde : onverzadigde vetzuren veresterd aan de glycerol in PA, waarbij dit bij eieren vooral verzadigde vetzuren zijn, en er bij soja wat meer onverzadigde vetzuren aanwezig zijn. Er was al eerder gehypothetiseerd dat PA met twee verzadigde vetzuren een verhoogde kans op opslag heeft, terwijl met 1 verzadigd en 1 onverzadigd vetzuur het meer betrokken is bij signalering. Desalniettemin lijkt me dit in een klinische setting vooral afhankelijk van je dieet. Immers worden triacylglycerolen, maar dus ook PA, gehydrolyseerd waardoor je je vrije vetzuren en monoacylglycerol krijgt waarna de boel later weer ‘in elkaar’ wordt gezet.
Dan de klinische studie: 28 mannen (21 + jaar, 77 + 7 kg, 176 + 9 cm) vormden de steekproef. De mannen moesten minstens 1 jaar krachttraining ervaring hebben, waarvan het laatste half jaar minstens driemaal per week de sportschool bezoekten. Voor de studie werd er een geperiodiseerd trainingsschema gehanteerd, waarbij er driemaal per week werd getraind. Er werd o.a. gebenched, geBOR’ed en gesquat. De PA groep (750 mg PA ED) en placebo groep werden gematched. Er werd gekeken naar de lichaamscompositie (d.m.v. DEXA), CSA van de rectus femoris, kracht (d.m.v. leg press 1 RM en bench press 1 RM), en anaeroob vermogen (d.m.v. Wingate test).
De vetvrije massa steeg significant meer in de PA groep (voor: 59.7 + 6.0 kg, na: 62.1 + 5.5 kg, ES = 0.42) t.o.v. de placebo groep (voor: 59.5 + 4.7 kg, na: 60.7 + 4.7 kg, ES = 0.26). Ook steeg de CSA van de rectus femoris significant meer in de PA groep (voor: 4.5 + 1.1 cm2, na: 5.5 + 1.3 cm2, ES = 0.92) t.o.v. de placebo groep (voor 4.5 + 1.1 cm2, na: 5.1 + 1.2 cm2, ES = 0.52). Er waren geen significante verschillen in de totale massa tussen beide groepen, en een trend (P = 0.068) voor een daling in vetmassa in de PA groep t.o.v. de placebo groep.
De 1 RM op de leg press steeg significant meer in de PA groep (voor: 228.7 + 49.5 kg, na: 280.6 + 36.2 kg, ES = 1.2) t.o.v. de placebo groep (voor: 226.3 + 47.2 kg, na: 258.7 + 36.1 kg, ES = 0.78). De 1 RM op de bench press steeg niet significant meer in de PA groep t.o.v. de placebo groep, al was er wel een trend (P = 0.11). De Wingate test liet verder geen verschillen tussen beide groepen zien.
Conclusie
Fosfatidezuur suppletie laat de VVM stijgen in combinatie met krachttraining en doet dit hoogstwaarschijnlijk door direct de eiwitsynthese te stimuleren via mTOR activatie. Ook geeft het enigszins meer kracht (waarschijnlijk door de toename van myofibrillaire eiwitten) en laat het misschien ook de vetmassa dalen. En dat allemaal door een beetje PA suppletie. Ik ben benieuwd wanneer de eerste supplementenboer op de Nederlandse markt dit supplement gaat lanceren.
Referenties
- Joy, Jordan M., et al. “Phosphatidic acid enhances mTOR signaling and resistance exercise induced hypertrophy.” Nutrition & Metabolism 11.1 (2014): 29.
- Hornberger, Troy A. “Mechanotransduction and the regulation of mTORC1 signaling in skeletal muscle.” The international journal of biochemistry & cell biology 43.9 (2011): 1267-1276.
- Fang, Yimin, et al. “Phosphatidic acid-mediated mitogenic activation of mTOR signaling.” Science 294.5548 (2001): 1942-1945.
- Hornberger, T. A., et al. “The role of phospholipase D and phosphatidic acid in the mechanical activation of mTOR signaling in skeletal muscle.” Proceedings of the National Academy of Sciences of the United States of America 103.12 (2006): 4741-4746.
- Myers, Martin G., et al. “IRS-1 activates phosphatidylinositol 3′-kinase by associating with src homology 2 domains of p85.” Proceedings of the National Academy of Sciences 89.21 (1992): 10350-10354.
- Alessi, Dario R., et al. “Characterization of a 3-phosphoinositide-dependent protein kinase which phosphorylates and activates protein kinase Bα.” Current Biology 7.4 (1997): 261-269.
- Calleja, Véronique, et al. “Intramolecular and intermolecular interactions of protein kinase B define its activation in vivo.” PLoS biology 5.4 (2007): e95.
- Sarbassov, Dos D., et al. “Phosphorylation and regulation of Akt/PKB by the rictor-mTOR complex.” Science 307.5712 (2005): 1098-1101.
- Inoki, Ken, et al. “TSC2 is phosphorylated and inhibited by Akt and suppresses mTOR signalling.” Nature cell biology 4.9 (2002): 648-657.
- Sancak, Yasemin, et al. “PRAS40 is an insulin-regulated inhibitor of the mTORC1 protein kinase.” Molecular cell 25.6 (2007): 903-915.
- Hardie, D. Grahame, Fiona A. Ross, and Simon A. Hawley. “AMPK: a nutrient and energy sensor that maintains energy homeostasis.” Nature reviews Molecular cell biology 13.4 (2012): 251-262.
- Gwinn, Dana M., et al. “AMPK phosphorylation of raptor mediates a metabolic checkpoint.” Molecular cell 30.2 (2008): 214-226.
- Gulati, Pawan, et al. “Amino Acids Activate mTOR Complex 1 via Ca2+/CaM Signaling to hVps34.” Cell metabolism 7.5 (2008): 456-465.
- Sancak, Yasemin, et al. “Ragulator-Rag complex targets mTORC1 to the lysosomal surface and is necessary for its activation by amino acids.” Cell 141.2 (2010): 290-303.
- Adegoke, Olasunkanmi AJ, Abdikarim Abdullahi, and Pegah Tavajohi-Fini. “mTORC1 and the regulation of skeletal muscle anabolism and mass.” Applied Physiology, Nutrition, and Metabolism 37.3 (2012): 395-406.
- O’Neil, Tyriina K., et al. “The role of phosphoinositide 3-kinase and phosphatidic acid in the regulation of mammalian target of rapamycin following eccentric contractions.” The Journal of physiology 587.14 (2009): 3691-3701.
- Ma, Xiaoju Max, and John Blenis. “Molecular mechanisms of mTOR-mediated translational control.” Nature reviews Molecular cell biology 10.5 (2009): 307-318.


Mooi stuk Peter!
Nu hopen op goede verkrijgbaarheid binnenkort!
Groet,
Evert
Weet je ook over welke vorm van PA het precies gaat? PA blijkt namelijk niet een specifieke stof te zijn.
Hoi Rodney,
PA is inderdaad een verzamelnaam, de algemene structuurformule staat uitgebeeld in het eerste figuur. Uit het onderzoek blijkt dat meerdere varianten werken, maar degene met 1 onverzadigd vetzuur en 1 verzadigd vetzuur aan de glycerol gekoppeld (afgeleid van soja) bracht het er beter vanaf dan met 2 verzadigde vetzuren aan de glycerol gekoppeld (afgeleid van ei). Dit komt waarschijnlijk doordat deze laatste in de cel eerder wordt opgeslagen, i.p.v. dat deze voor signalering wordt gebruikt. Het onderzoek deed volgens mij geen vermelding van de lengte van de vetzuren ketens, maar ik denk dat je kunt uitgaan van de gangbare lengtes, i.e. 16 of 18 C-atomen lang gekoppeld aan het eerste C-atoom van de glycerol, en 16, 18 of 20 C-atomen lang gekoppeld aan het tweede C-atoom van de glycerol. Dit zijn alleszins de lengtes die je in cellen/voeding voornamelijk tegenkomt.
Praktisch gezien, zou je het willen suppleren, zou je dus PA afgeleid van soja willen hebben.
Groet,
Peter