Testosteron is een belangrijke speler betrokken bij spierhypertrofie. Een deel van diens mechaniek hierin heb ik eerder besproken in het artikel over de Androgeen Receptor. Atleten die suprafysiologische doseringen van androgene anabole steroïden toedienen zetten makkelijker spiermassa aan dan wanneer zij dit niet doen, en mannen lijdend aan hypogonadisme (verlaagde testosteron productie) worden gekenmerkt door meer vetmassa en minder vetvrije massa dan hun gezonde tegenhangers.
Maar hoe wordt de endogene testosteron productie eigenlijk gereguleerd? En hoe wordt het gemaakt? De regulatie is onder invloed van een complex samenspel van steroïde hormonen en peptiden die zowel endogene als exogene signalen uitoefenen. Het geheel vormt een endocriene as, genaamd de hypothalamus-hypofyse-gonadale (HPG) as. De uiteindelijke productie, in de testes, betreft een complex samenspel van enzymen die uiteindelijk testosteron synthetiseren uit cholesterol (steroidogenese). In dit artikel zal ik alleen de productie in mannen, en meer specifiek in de testes, beschouwen. Productie in de bijnier is echter analoog hieraan, als ook de productie in de eierstokken (met wat nuance verschillen).
HPG as: de componenten
Zoals valt af te leiden uit de naam, wordt de HPG as gevormd door een samenspel van de hypothalamus, hypofyse en de gonaden (testes bij mannen, eierstokken bij vrouwen). Het is een hiërarchische endocriene as met de hypothalamus aan de top, gevolgd door de hypofyse en uiteindelijk de testes.
De hypothalamus is gelegen in de hersenen en vormt de signaal integrator van tal van endocriene en neuronale signalen, en is niet louter onderdeel van de HPG as. De hypothalamus kan weer onderverdeeld worden in verscheidene delen, waarvan zogehete kernen de kleinste, gespecialiseerde, delen vormen. Nauw betrokken bij de regulatie van de geslachtshormonen zijn de infundibulaire (INF) kern en de preoptische regio (POA, preoptic area). In het kader van de HPG as is het hormoon GnRH interessant, een peptide die wordt gesynthetiseerd door GnRH neuronen gelegen in de POA. De GnRH neuronen diens axonen projecteren helemaal tot de median eminence (ME) aan de onderzijde van de hypothalamus. Van daaruit wordt het in het bloed afgegeven waarna het bij de hypofyse terecht komt.
De hypofyse is gelegen onder de hypothalamus en is evenzo niet louter betrokken bij de HPG as, maar synthetiseert en integreert tal van hormonen. De hypofyse kunnen we onderverdelen in de adenohypofyse (de voorzijde) en de neurohypofyse. De adenohypofyse secreert hormonen, waaronder de gonadotrofines luteïniserend hormoon (LH) en follikel stimulerend hormoon (FSH), die centraal staan in de HPG as. De neurohypofyse bestaat uit neurale cellen die hormonen afgeven via hun axonen. De hormonen worden oorspronkelijk gesynthetiseerd in de hypothalamus, waarna zij worden getransporteerd naar en opgeslagen in de neurohypofyse. LH en FSH worden afgegeven in reactie op binding van GnRH aan de GnRH receptor (GnRHR), en komen terecht in de circulatie, waarna ze bij de testes belanden.
De testes bestaat uit verscheidene typen cellen, waaronder de Leydig en Sertoli cellen. De eerste bevat LH receptoren (LHR), en de tweede bevat FSH receptoren (FSHR). In het kader van de testosteron productie, zijn met name de Leydig cellen interessant: zij bevatten alle enzymen voor de steroidogenese. LH induceert de testosteron productie na binding aan de LHR.
Uiteindelijk komt het geproduceerde testosteron terecht in de circulatie, waarna het gemetaboliseerd wordt in overige weefsels, waaronder naar oestradiol door het aromatase enzym. Ook wordt er in de testes zelf al oestradiol gesynthetiseerd, circa 15% tot 25% van het oestradiol in de circulatie is afkomstig van de testes [1]. Deze geslachtshormonen koppelen vervolgens terug aan de adenohypofyse en hypothalamus, en verminderen hiermee uiteindelijk hun eigen productie: een klassiek geval van negatieve terugkoppeling.
Kisspeptines: een doorbraak
Hoe GnRH precies werd gereguleerd is zeer lang een mysterie gebleven. In 1983 werd in het prestigieuze Nature een studie gepubliceerd die al sterk suggereerde dat de effecten van oestrogeen op GnRH niet direct via de GnRH neuronen werden gemedieerd [2]. Hoewel recentere studies tot op zekere hoogte toch directe regulatie van oestrogeen laten zien [3], wordt er in delen van de literatuur (voor het gemak?) uitgegaan dat GnRH neuronen geen AR, noch ER-alfa tot expressie brengen, en zodoende leunen op een indirect mechanisme van GnRH regulatie [4]. Wat echter buiten kijf staat, is dat de geslachtshormonen inderdaad primair indirect inwerken op regulatie van GnRH, via zogehete KNDy cellen [5].
De K in KNDy staat voor kisspeptine. De ontdekking van diens rol in fertiliteit, in 2003, was een ontzettende doorbraak in het vakgebied [6,7] (getuige ook de meer dan 2000 citaties in totaal van beide publicaties). De KNDy cellen staan namelijk centraal in de regulatie van GnRH. Zij zijn de cellen waar via, o.a. geslachtshormonen, indirect hun effect uitoefenen op de GnRH neuronen. Inderdaad, zij brengen de ER-alfa, PR en AR tot expressie [5].
Kisspeptines is een verzamelnaam voor vier peptides van 54, 14, 13 en 10 aminozuren lang. Zij zijn allen afkomstig van dezelfde propeptide (kisspeptin-145), die wordt beschreven door 1 gen, namelijk het KISS1 gen.
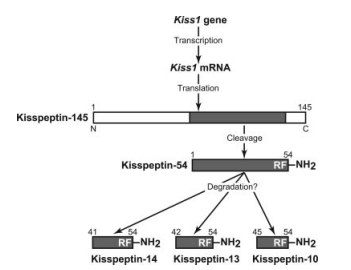
Al deze vier peptides zijn biologisch actief, echter is waarschijnlijk de kisspeptine-54 in vivo de belangrijkste speler (mogelijk door een langere halfwaarde tijd). GnRH neuronen brengen de kisspeptine receptor (KISS1R) tot expressie, een G-proteïne gekoppelde receptor (GPCR). Na binding aan de KISS1R, wordt de G-proteïne geactiveerde fosfolipase C (PLC) geactiveerd. PLC hydroliseert een fosfolipide in het celmembraan, namelijk PIP2. Dit vormt de second messengers diacylglycerol (DAG) en inositol 1,4,5-trifosfaat (IP3), en zodoende werkt het dus via de bekende IP3/DAG pathway. DAG blijft gelokaliseerd bij het celmembraan en activeert de kinase PKC, terwijl IP3 zich door het cytoplasma beweegt en zijn weg vindt naar het endoplasmatisch reticulum (ER). Na binding aan de IP3 receptor komt er veel Ca+ vrij uit het ER in het cytoplasma. PKC fosforyleert op zijn beurt weer eiwitten die ook reageren op de gestegen Ca+ concentratie, en de uiteindelijke signaleringscascade leidt tot depolarisatie van het membraan [8].
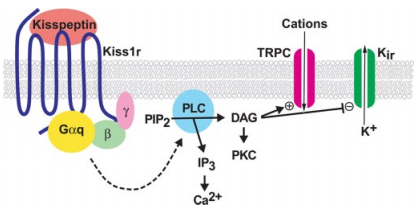
Toediening van de peptide bij gezonde mensen zorgt inderdaad ook voor een stijging in de gonadotrofine concentraties in het serum, en resulterend testosteron [9]. Hetzelfde effect is evenzo gevonden bij verscheidene populaties [10]. Langdurige toediening zorgt na verloop van tijd echter voor een daling van de gonadotrofines, waarschijnlijk door down-regulatie en sensitisatie van de GnRHR [4]. Deze bevinding benadrukt de relevantie van het pulsatiele karakter waarmee GnRH fysiologisch wordt afgegeven.
Neurokinine B en dynorfine
Waarschijnlijk zit je als lezer nog met de vraag waar de N en Dy voor staan van de KNDy cellen. De N staat voor neurokinine B, en Dy voor dynorfine. Beide peptides zijn sterk gecolocalizeerd met kisspeptine in dezelfde cellen (i.e. zij komen tot expressie in dezelfde cellen) [5]. I.t.t. de kisspeptines, die zowel in de POA als in de INF kern tot expressie komen, komen deze peptides alleen tot expressie in de INF kern [10]. De KNDy cellen brengen zowel de receptor voor neurokinine B (neurokinine B receptor), als de receptor voor dysnorfine (kappa opiode peptide receptor) tot expressie, maar niet de KISS1R. Dit duidt op autocriene en/of paracriene regulatie van de KNDy cellen door neurokinine B en dysnorfine. Zeer zeker gegeven dat de axonen van de KNDy cellen elkaar ook koppelen.
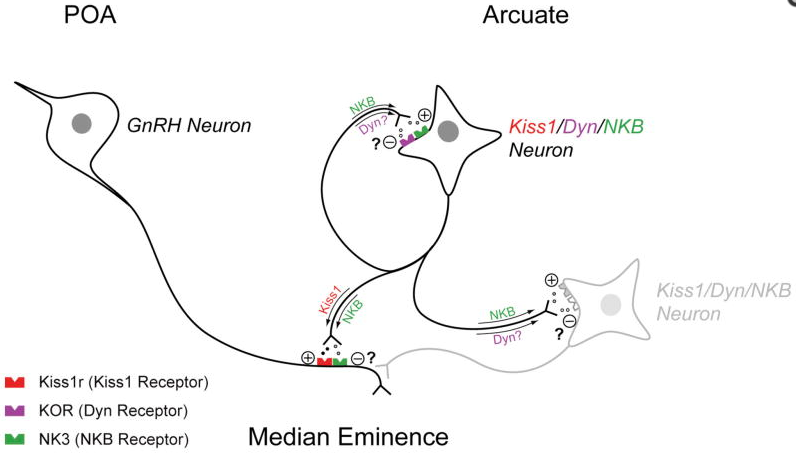
Navarro et al. hebben een model voorgesteld van deze regulatie [11]. Wanneer de KNDy cellen actief worden, wordt via autocriene en paracriene regulatie van neurokinine B de activiteit versterkt, waardoor uiteindelijk een puls van kisspeptine secretie ontstaat die de axonen van de GnRH neuronen in de ME bereiken. Met een vertraging arriveert de activiteit van dynorfine uiteindelijk ook bij de KNDy populatie, die als een negatieve regulator fungeert. Na een tijd loopt dit signaal af, en begint de cyclus opnieuw met resulterend een puls. De GnRH puls heeft resulterende een puls van gonadotrofine secretie als gevolg, en stimuleert zodoende de testosteron productie in de testes.
KISS1 neuronen en signaalintegratie van endogene en exogene factoren
In onderstaande afbeelding is een abstractie te zien van de signaalintegratie die de HPG as reguleert op niveau van de hypothalamus.
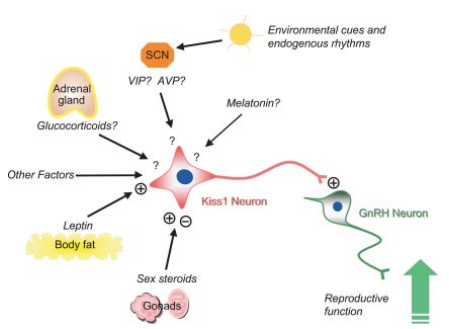
Zoals bekend zorgen steroïde hormonen, zoals oestradiol en testosteron, voor negatieve terugkoppeling op de HPG as. Deze hormonen down-reguleren de expressie van het KISS1 gen, en zorgen zo dus upstream van GnRH voor een negatief effect op de HPG as. Bovendien onderdrukt testosteron ook selectief de synthese van de LH beta-subunit in de adenohypofyse [12]. Het concept van de anticonceptiepil is dan ook grotendeels gebaseerd op deze effecten van onderdrukking van de afgifte van de gonadotrofines, zoals ik ook kort heb beschreven in mijn artikel: Anticonceptiepil en de sportschool: is het nadelig?.
Ook de rol van metabole status is de literatuur niet ontgaan bij de regulatie van de HPG as. Dit ligt o.a. grotendeels ten grondslag aan atletische amenorroe. Een belangrijke regulator hierin lijkt het hormoon leptine, een hormoon gesynthetiseerd door adipocyten (vetcellen). De effecten van leptine op KISS1 productie lijken indirect gemedieerd te worden via NPY en POMC. Leptine remt de activiteit van NPY neuronen die op hun beurt een remmend effect hebben op kisspeptine neuronen. Daarnaast activeert leptine POMC cellen die op hun beurt weer kisspeptine neuronen activeren [13]. Ook heeft leptine waarschijnlijk direct effect op KNDy cellen, gezien zij de leptine receptor tot expressie brengen [14]. Verder reguleert leptine misschien ook (tenminste gedeeltelijk) de effecten van glucocorticoiden, groeihormoon, insuline en IGF-I op de HPG as, gezien zij allen leptine expressie lijken te beinvloeden [13]. Zodoende vormt leptine expressie ook als een upstream integrator van overige hormonen m.b.t. HPG as regulatie. Ook lijkt er een directe metabole sensor te zijn, onafhankelijk van leptine. De beschikbaarheid van glucose of vetzuren voor oxidatie hebben binnen een zeer korte periode (<1u) al effect op de HPG as [15]. Dit kan het resultaat zijn van veranderingen in de ATP:AMP ratio (waarschijnlijk via AMPK activatie die GnRH neuronen remt [16]), dan wel producten van deze energie leverende moleculen gevormd in bijv. de citroenzuurcyclus. Echter zorgt toediening van glucose aan mensen voor een acute daling in LH en testosteron [17]. Hoe dit gebeurt is nog onduidelijk, maar het zou kunnen komen door o.a. het effect op de insuline secretie van glucose, i.p.v. een direct effect van glucose. Ook zou het kunnen dat het effect heeft downstream van de GnRH neuronen.
LH & FSH: de gonadotrofines
De gonadotrofines, LH & FSH, zijn heterodimerisch glycoproteïne, bestaande uit twee subeenheden: de alfa en beta subeenheid. De alfa subeenheid van beide zijn gelijk, ook TSH en hCG delen deze subeenheid. De beta subeenheid van allen is wel uniek en is belangrijk voor de specificiteit voor de betreffende receptor. De gonadotrofines worden gesynthetiseerd en afgegeven aan de circulatie door de adenohypofyse in reactie op GnRH. De frequentie van de GnRH pulsen is gedeeltelijk verantwoordelijk voor de differentiële secretie van de gonadotrofines. Een hogere GnRH pulsatie frequentie leidt tot meer afgifte van LH relatief aan FSH en vice versa [18].
LH en FSH binden aan de LHR en FSHR respectievelijk. Beide zijn membraanreceptoren en komen tot expressie in de Leydig cellen (LHR) en Sertoli cellen (FSHR). In het kader van de testosteron productie is de LHR vooral interessant, hoewel activatie van de FSHR ook een subtiele rol speelt.
De LHR is een G-proteïne gekoppelde receptor en na binding van een ligand wordt de G-proteïne geactiveerd. De G-proteine activeert op zijn beurt weer adenylate cyclase. Dit enzym catalyseert ATP naar de second messenger cAMP. Deze stijging in intracellulair cAMP activeert de cAMP afhankelijke kinase eiwit kinase A (PKA). PKA fosforyleert en activeert hiermee de CRE bindings eiwitten (CREBPs), cAMP-responsive elementen (CREs) en transcriptiefactoren, allen betrokken bij de steroidogenese. In de afwezigheid van cAMP, vindt er geen expressie plaats van CYP17A1, die het enzym (17alfa-hydroxylase) beschrijft die de reactie van pregnenolon en progesteron catalyseert naar DHEA en androstenedion, respectievelijk. Hierbij hydroxyleert het enzym C17, gelegen op de D-ring. Andere benodigde enzymen voor de productie van testosteron, zoals 3beta-HSD en P450scc, hebben al een vrij hoge basale transcriptie. Desalniettemin wordt de transcriptie van 3beta-HSD ook geïnduceerd, het enzym die androstenediol catalyseert naar testosteron, en DHEA naar androstenedion (die vervolgens door 17beta-HSD geconverteerd kan worden naar testosteron).
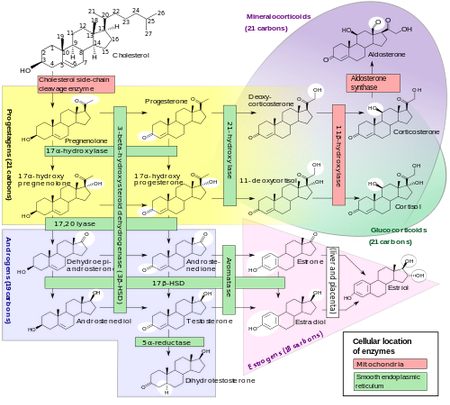
Verder vindt er zelfs op de niveau van de testes al negatieve terugkoppeling plaats door androgenen. Zowel de synthese van het 17alfa-HSD enzym wordt verlaagd door testosteron (via de AR), als ook wordt de afbraak van het enzym versneld [19].
Testosteron en oestradiol: de geslachtshormonen
Het eindpunt van de HPG as zijn de geslachtshormonen: testosteron en oestradiol. Testosteron is het voornaamste product van de steroidogenese in de testes. Daarnaast is een deel van het oestradiol in de circulatie ook direct afkomstig van de testes, circa 15-25% [1]. Testosteron en oestradiol koppelen vervolgens negatief terug aan de hypothalamus en adenohypofyse, zoals eerder besproken. Testosteron kan verder converteren naar het potentere androgeen, 5alfa-dihydrotestosteron, gecatalyseerd door 5alfa-reductase. Ondanks dat 5alfa-dihydrotestosteron een sterker androgeen is, speelt het waarschijnlijk geen rol bij spierhypertrofie. Het 5a-reductase enzym is nauwelijks aanwezig in spierweefsel [20] en bovendien zou enige 5alfa-DHT snel gemetaboliseerd worden door de aanwezigheid van het 3alfa-HSD enzym [21]. Daarom is 5alfa-DHT geen populaire AAS onder atleten, en stellen andere 5-alfa-3-keto-steroiden (substraten voor 3alfa-HSD) vaak teleur t.o.v. hun androgene potentie. 5alfa-dihydrotestosteron medieert daarom vooral de androgene effecten van testosteron, en komt voornamelijk tot expressie in huidweefsel [20].
Conclusie
De HPG as wordt gecoördineerd door een complex samenspel van allerlei endogene en exogene signalen. Zelfs in bovenstaand grote lap tekst laat ik veel dingen buiten beschouwing. Zo zijn er meerdere neuropeptides betrokken bij de regulatie van de KISS1 neuronen, is er nog een tweede pathway die geactiveerd wordt door de LHR, en nog vele andere dingen. Desalniettemin licht dit artikel de kern van de zaak uit en helpt het in het begrijpen van externe factoren en diens invloed op de testosteron productie. Uiteraard is productie slechts 1 deel van het verhaal; de andere kant van het verhaal is de metabolisatie. Je kunt nog zoveel produceren, maar als het snel wordt gemetaboliseerd (of door binding aan SHBG niet bruikbaar is), voegt het weinig toe.
Referenties
- Melmed, Shlomo, et al. Williams textbook of endocrinology: Expert consult. Elsevier Health Sciences, 2011.
- Shivers, B. D., et al. “Absence of oestradiol concentration in cell nuclei of LHRH-immunoreactive neurones.” (1983): 345-347.
- Ng, Yewade, et al. “Estrogen regulation of gene expression in GnRH neurons.” Molecular and cellular endocrinology 303.1 (2009): 25-33.
- Oakley, Amy E., Donald K. Clifton, and Robert A. Steiner. “Kisspeptin signaling in the brain.” Endocrine reviews 30.6 (2009): 713-743.
- Lehman, Michael N., Lique M. Coolen, and Robert L. Goodman. “Minireview: kisspeptin/neurokinin B/dynorphin (KNDy) cells of the arcuate nucleus: a central node in the control of gonadotropin-releasing hormone secretion.” Endocrinology 151.8 (2010): 3479-3489.
- de Roux, Nicolas, et al. “Hypogonadotropic hypogonadism due to loss of function of the KiSS1-derived peptide receptor GPR54.” Proceedings of the National Academy of Sciences 100.19 (2003): 10972-10976.
- Seminara, Stephanie B., et al. “The GPR54 gene as a regulator of puberty.” New England Journal of Medicine 349.17 (2003): 1614-1627.
- Zhang, Chunguang, et al. “Kisspeptin depolarizes gonadotropin-releasing hormone neurons through activation of TRPC-like cationic channels.” The Journal of neuroscience 28.17 (2008): 4423-4434.
- Dhillo, Waljit S., et al. “Kisspeptin-54 stimulates the hypothalamic-pituitary gonadal axis in human males.” Journal of Clinical Endocrinology & Metabolism 90.12 (2005): 6609-6615.
- Skorupskaite, Karolina, Jyothis T. George, and Richard A. Anderson. “The kisspeptin-GnRH pathway in human reproductive health and disease.” Human Reproduction Update (2014): dmu009.
- Navarro, Victor M., et al. “Regulation of gonadotropin-releasing hormone secretion by kisspeptin/dynorphin/neurokinin B neurons in the arcuate nucleus of the mouse.” The Journal of Neuroscience 29.38 (2009): 11859-11866.
- Veldhuis, Johannes D., et al. “Age disrupts androgen receptor-modulated negative feedback in the gonadal axis in healthy men.” American Journal of Physiology-Endocrinology and Metabolism 299.4 (2010): E675.
- Hausman, Gary J., C. Richard Barb, and Clay A. Lents. “Leptin and reproductive function.” Biochimie 94.10 (2012): 2075-2081.
- Smith, J. T., et al. “KiSS‐1 neurones are direct targets for leptin in the ob/ob mouse.” Journal of neuroendocrinology 18.4 (2006): 298-303.
- Schneider, Jill E. “Energy balance and reproduction.” Physiology & behavior 81.2 (2004): 289-317.
- Roland, Alison V., and Suzanne M. Moenter. “Glucosensing by GnRH neurons: inhibition by androgens and involvement of AMP-activated protein kinase.” Molecular endocrinology 25.5 (2011): 847-858.
- Iranmanesh, Ali, Donna Lawson, and Johannes D. Veldhuis. “Glucose ingestion acutely lowers pulsatile LH and basal testosterone secretion in men.” American Journal of Physiology-Endocrinology and Metabolism 302.6 (2012): E724.
- Ferris, Heather A., and Margaret A. Shupnik. “Mechanisms for pulsatile regulation of the gonadotropin subunit genes by GNRH1.” Biology of reproduction 74.6 (2006): 993-998.
- Hales, D. B., L. L. Sha, and A. H. Payne. “Testosterone inhibits cAMP-induced de Novo synthesis of Leydig cell cytochrome P-450 (17 alpha) by an androgen receptor-mediated mechanism.” Journal of Biological Chemistry 262.23 (1987): 11200-11206.
- Thigpen, A. E., et al. “Tissue distribution and ontogeny of steroid 5 alpha-reductase isozyme expression.” Journal of Clinical Investigation 92.2 (1993): 903.
- Massa, R., and L. Martini. “Testosterone metabolism: A necessary step for activity?.” Journal of Steroid Biochemistry 5.8 (1974): 941-947.